
Centrexion Therapeutics Corp.(NASDAQ:CNTX)创立于2013年2月,总部位于美国马萨诸塞州Boston,全职雇员14人,是一家后期临床阶段的生物制药公司,专注于识别,开发和商业化新型,非阿片类和非成瘾性疗法,以解决治疗慢性疼痛的大量未满足的医疗需求。

Centrexion Therapeutics Corp(CNTX)美股百科
2011年数据,美国有超过4,000万成年人和全球超过10亿人每年患有慢性疼痛。这种病在直接治疗、康复支出、工人生产力下降、阿片类药物普遍成瘾、患者及其家属的情感和经济负担方面付出巨大代价。
世界卫生组织(WHO)和欧盟委员会估计,到2050年,全世界骨关节炎(OA)的患病率将影响1.3亿人,其中4,000万人将严重致残。根据美国国家科学院医学研究所的报告,疼痛是美国一个重要的公共卫生问题,每年造成社会损失5600至6350亿美元。
尽管疼痛问题很严重,但治疗解决方案的开发创新基本上没有。自2010年以来,美国食品和药物管理局(FDA)只批准了19款疼痛治疗药物,其中11种为阿片类药物变体,1种为缓释型的通用皮质类固醇,5种为阿司匹林变体,2种为其他现有药物变异。
Centrexion Therapeutics Corp.正在开发一系列新产品候选产品,旨在克服目前慢性疼痛治疗方案的局限性,并为患者和医生提供更好,更安全的治疗方案。
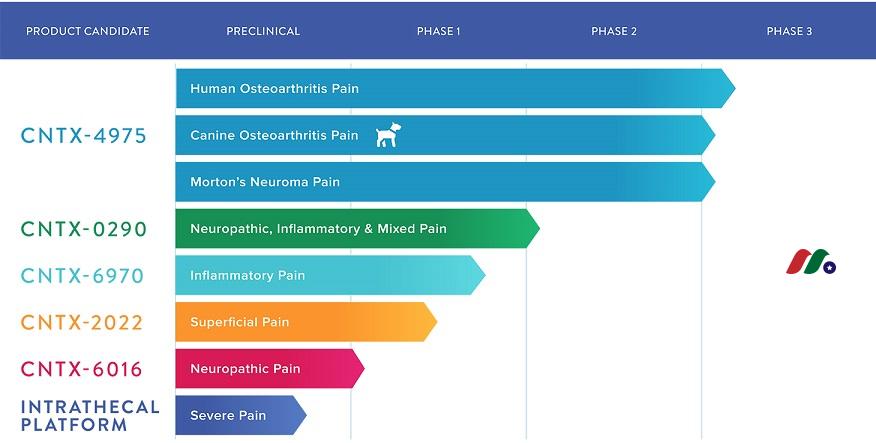
Centrexion Therapeutics公司最先进的候选产品CNTX-4975旨在选择性地和局部地靶向和破坏疼痛感应神经纤维的信号传导。CNTX-4975正处于关键的 III 期开发阶段,用于治疗膝关节引起的中度至重度疼痛。在一项针对175名膝关节中度至重度疼痛患者的 II 期随机、双盲、安慰剂对照临床试验中,公司观察到,与安慰剂相比,接受单次关节内注射1.0的受试者:
- 平地上行走时疼痛有统计学意义和临床意义上的减少。
- 第二天观察到疼痛开始缓解。
- 持久缓解疼痛,持续治疗一个月后缓解疼痛六个月。
- 膝盖刚度的改善。
- 改善膝关节功能。
- 在IA注射后24小时,CNTX-4975没有可检测的全身暴露。
在2018年第一季度,Centrexion Therapeutics公司开始在VICTORY-1中注册科目,这是CNTX-4975的两个计划关键的第 III 阶段注册试验中的第一个,预期在2020年第一季度报告一线结果。
在2018年下半年,Centrexion Therapeutics开始招募OA-303受试者,一项开放标签安全试验,约850名受试者,第二次关键的CNTX-4975第 III 期注册试验——VICTORY-2,包括重复给药。预计将于2019年下半年报告OA-303数据并于2020年下半年报告VICTORY-2的最终结果。
如果这些试验的结果是积极的,Centrexion Therapeutics计划在2021年下半年在美国提交新药申请(NDA),并在欧洲提交上市许可申请(MAA)。
CNTX-4975于2018年1月被FDA授予快速通道指定,用于治疗膝关节相关的中度至重度疼痛。
Centrexion Therapeutics Corp(CNTX)全部候选产品及临床开发所处阶段:
Centrexion Therapeutics Corp(CNTX)美股投资
Centrexion Therapeutics Corp.(NASDAQ:CNTX)于10/19/2018递交IPO招股说明书,计划于11/15/2018 IPO登陆纳斯达克,发行价14.00-16.00美元,发行500万股,募资不超过9200万美元,BofA Merrill Lynch/ Leerink Partners/ Evercore ISI承销。
2020年5月5日,正在开发用于慢性疼痛的非阿片类药物疗法的Centrexion Therapeutics在周三撤回了首次公开募股(IPO)的计划。 它最初在2018年11月申请以14至16美元的发行价发行500万股股票来筹集7500万美元,然后于当月晚些时候推迟了交易。 自2019年12月以来,该公司尚未提交更新。




评论