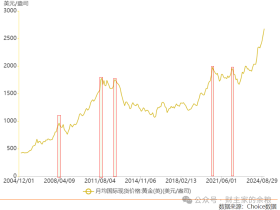
2014年10月10日FDA批准了ledipasvir和sofosbuvir(Harvoni™) 联合治疗用于丙型肝炎。这一联合产品是治疗基因型为1型的丙型肝炎的这一类药物中的第一个。这一药物的主要优势是不需要同时服用干扰素或利巴韦林。三期临床试验检测了这一药物联用方案在1518位初治或经治患者中的疗效。发现94%的应用ledipasvir/sofosbuvir治疗8周的患者和96% 的应用这一联合方案治疗12周的患者达到了持续病毒学缓解。

Ledipasvir和sofosbuvir的作用机制不同。Ledipasvir抑制病毒复制所需的HCV NS5A蛋白。Sofosbuvir抑制HCV NS5B RNA依赖性RNA聚合酶,这种酶也是复制所需要的酶。更具体的说,sofosbuvir是一种核苷酸前体药物,它经过细胞内的机制形成HCV RNA,它是该反应链的终点。它只针对HCV,不会干扰人类DNA, RNA或线粒体RNA聚合酶。
一粒药中包含90mg的ledipasvir和400mg的sofosbuvir。目前推荐该药作为没有肝硬化的患者的一线药物。剂量说明已经简化为每天餐前或餐后口服一粒。

2014年9月14日,吉利德(Gilead)宣布与七家印度药厂达成一项自愿授权(VL)协议。这项协议将允许这些公司在91个国家中生产和销售吉利德(Gilead)的丙肝病毒(HCV)直接作用抗病毒药物(DAA): 索非布韦(Sovaldi©)和ledipasvir的仿制药。但是吉利德的授权排除其他住着7300万HCV患者的国家, 让他们无法取得较便宜的仿制药。 因此,吉利德的授权协议将全世界46%需要HCV治疗的患者排除在外。
QQ群:249342519
加群验证:美股之家

249342519
微信公众号
美港股百科全书

mggbkqs








评论