
Vedanta Biosciences, Inc.创立于2010年,总部位于美国马萨诸塞州Cambridge,Vedanta Biosciences 创建微生物组衍生疗法,通过调节肠道微生物群来解决免疫和传染病。

Vedanta Biosciences美股百科
人体就是一个生态系统。有数以万亿计的微生物在我们的体内生活。他们构成了人体微生物组,执行着维护我们健康的关键功能,包括调节我们的免疫系统和提供抵抗传染性病原体的定植抗性。人体微生物组的变化越来越被认识到是影响免疫和传染性疾病发展的关键因素。Vedanta Biosciences根据人类共生细菌的菌群理性设计药物来治疗疾病,利用来自微生物生态学、粘膜免疫学和人类干预研究的洞见。
Vedanta Biosciences, Inc.是一家总部位于美国马萨诸塞州的生物科技公司,专注于人体微生物组的研究。该公司成立于2010年,是全球领先的人体微生物组治疗公司之一。
Vedanta Biosciences的核心业务是研发和商业化利用人体内的微生物群体进行治疗的产品。这些微生物群体,也就是人体微生物组,包含了数十万亿的微生物,包括细菌、病毒、真菌等,它们在人体内与我们的健康紧密相关。
Vedanta Biosciences的科研团队利用高级的基因测序和生物信息学技术,发现并验证了微生物组在一系列疾病中的作用,包括自身免疫疾病、感染性疾病、肿瘤和中枢神经系统疾病等。基于这些发现,公司研发了多个临床阶段的药物候选物,目标是通过改变微生物组的构成和功能来治疗疾病。
Vedanta Biosciences产品线(候选产品线)
Vedanta是一家临床阶段的生物制药公司,正在开创性地研发定义的细菌菌群作为口服疗法,通过调节人体微生物组来治疗疾病。其产品线包括针对C. difficile感染、炎症性肠病、革兰氏阴性菌感染、实体瘤和食物过敏的药物候选产品。
1、VE303
VE303是一种口服的、理性设计的、由8种克隆的人类共生细菌菌株组成的定义细菌菌群候选物,正在针对高风险的艰难梭菌(CDI)感染进行研发。VE303的这8种菌株被选中是因为它们具有对艰难梭菌提供定植抗性的能力,并在cGMP条件下生产。它是从纯净的克隆细菌细胞库中在cGMP条件下生产出来的,以粉末形式的标准化药物产品,并且避免了依赖于直接采集粪便供体材料的不一致成分。
在一项针对高复发风险患者的二期试验中,VE303在八周内防止艰难梭菌感染复发的主要终点达标。这是基于理性设计的细菌菌群的最先进的临床试验药物,计划在2023年启动VE303的三期试验。
2、VE202
VE202是一种口服的、理性设计的细菌菌群候选物,正在开发中,有望用于治疗炎症性肠病(IBD)。VE202由克隆的人类共生细菌菌株组成,这些菌株被选中是因为它们能够影响肠粘膜中调节性T细胞的数量和活性,并在cGMP条件下生产。它是从纯净的克隆细胞库中生产出来的,以粉末形式的标准化药物产品,并且避免了依赖于直接采集粪便供体材料的不一致成分。由Vedanta Biosciences的联合创始人、日本慶应大学医学部的本田健也博士领导的VE202基础研究已经发表在Science和Nature杂志上。
2020年6月,Vedanta宣布了VE202的两项一期研究的积极顶线数据。VE202在所有剂量下都通常是安全的,容受良好,并显示出持久和剂量依赖性的定植。Vedanta预计将在2023年开始在IBD患者中进行二期研究。
3、VE800
VE800是一种口服的、理性设计的、定义的细菌菌群免疫肿瘤学候选物。VE800由11种克隆的人类共生细菌菌株组成,这些菌株在cGMP条件下生产,并被选出来是因为它们能够诱导CD8+ T细胞,增强免疫系统对肿瘤的攻击并增强检查点抑制剂的效果。它是从纯净的、非致病的克隆细菌细胞库中生产出来的,以粉末形式的标准化药物产品。Vedanta及其科学联合创始人本田健也博士进行的开创性工作,是VE800发现的基础,这项工作已在Nature杂志上发表。
VE800在第一例患者的临床试验中,与Bristol-Myers Squibb的检查点抑制剂OPDIVO®(nivolumab)联合应用,用于治疗选定类型的晚期或转移性癌症患者。尽管VE800显示出可接受的安全性和耐受性,但观察到的反应率并未达到预定的标准,以进入研究的下一阶段。
Vedanta正在分析那些观察到反应或疾病控制的患者的血液、粪便和肿瘤样本,以描述可能从微生物组操控中受益的患者亚型。这个分析的结果将决定VE800项目的下一步行动。
4、VE707
VE707是一个预临床发现项目,旨在预防多种多药耐药菌株(MDROs)的感染和定植复发,包括耐碳青霉烯类药物的肠杆菌科细菌(CRE)、产广谱β-内酰胺酶的菌株(ESBL)和耐万古霉素的肠球菌(VRE),这些都是最常见的医院获得性感染。VE707被设计为口服,由一种理性设计的细菌菌群组成,该菌群能够清除高风险患者肠道内MDROs的定植。它由纯净的克隆细菌细胞库生产,产出的产品成分均匀,没有任何致病菌株,避免了依赖成分不一致的粪便供体材料。
2019年12月,Vedanta宣布,它获得了由抗抗生素耐药细菌生物制药加速器(CARB-X)提供的580万美元的资助,以推进其VE707项目。
5、VE416
VE416是一种口服的、理性设计的、由克隆的人类共生细菌菌株组成的定义细菌菌群候选物,正在开发中,有望用于治疗食物过敏。VE416由选择出来的能够抑制过敏反应的克隆的人类共生细菌菌株组成,并在cGMP条件下生产。它是从纯净的、非致病的克隆细菌细胞库中生产出来的,以粉末形式的标准化药物产品。
2019年7月,Vedanta宣布已经有第一位患者参加了VE416的1/2期临床研究,该研究由马萨诸塞州总医院儿科过敏和免疫学主任、食物过敏中心主任Wayne Shreffler博士主持。该研究将在几个月的时间内探索VE416作为单一疗法以及与口服花生免疫疗法的联合应用。顶线数据预计将在2023年公布。
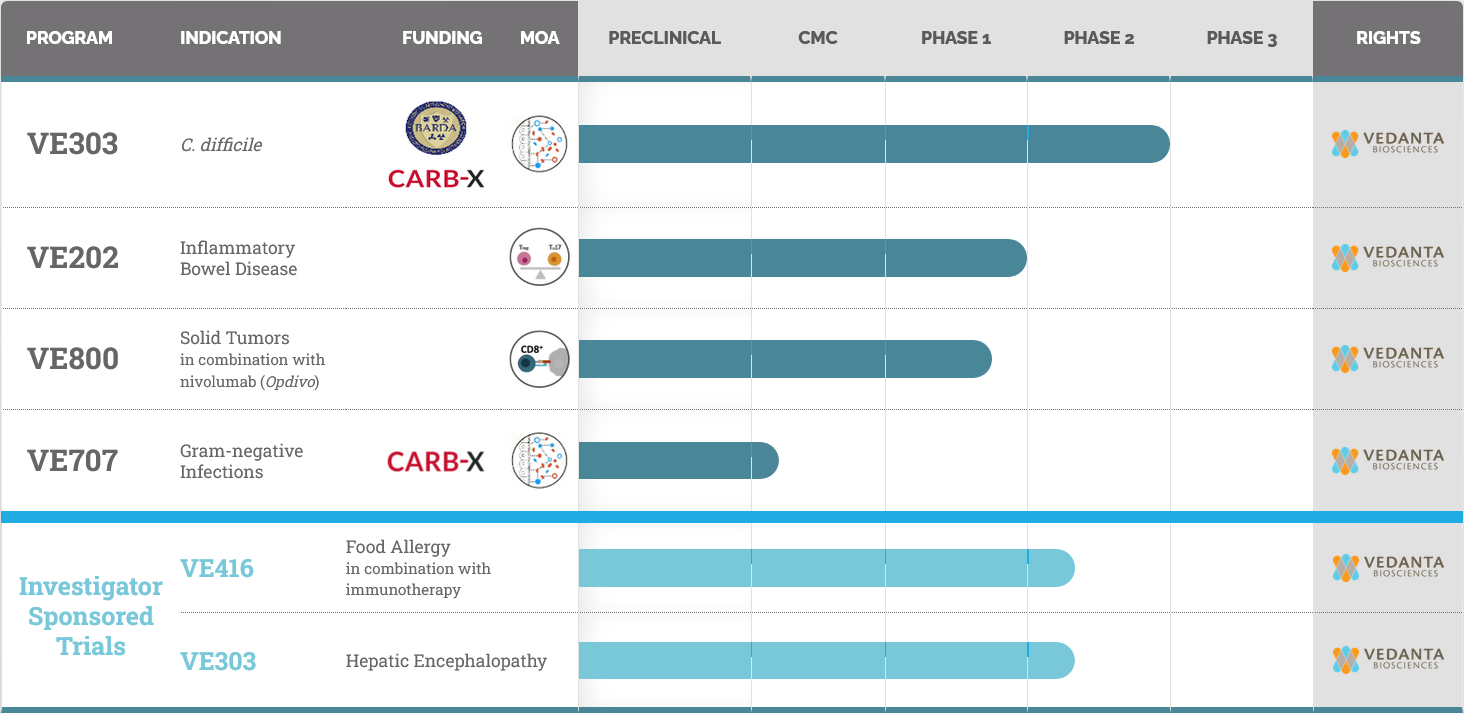
Vedanta Biosciences Pipeline
Vedanta Biosciences融资百科
2018年12月,Vedanta Biosciences完成4540万美元C轮融资,Seventure Partners、Bill & Melinda Gates Foundation、Rock Springs Capital、Bristol Myers Squibb、PureTech Health等共同参与。
2019年5月,Vedanta Biosciences完成1850万美元C+轮融资,Partners Investment、JSR Corp、Shumway Capital和Symbiosis Group共同参与。
2019年9月,Vedanta Biosciences完成1660万美元C++轮融资,Partners Investment、SV Investment Corp、Shinhan Capital、QUAD Investment Management、FC Capital等共同参与。
2019年12月,Vedanta Biosciences获得CARB-X 580万美元捐助。
2020年9月,Vedanta Biosciences获得Oxford Finance LLC 1500万美元债务融资资金。
2020年9月,Vedanta Biosciences获得Biomedical Advanced Research and Development Authority (BARDA) 7690万美元捐助。
2021年1月,Vedanta Biosciences获得Pfizer Breakthrough Growth Initiative独家2500万美元风险投资资金。
2021年7月,Vedanta Biosciences完成Magnetar Capital领投的6800万美元D轮融资,JSR Corp、Rock Springs Capital、PureTech Health、SymBiosis LLC等跟投。
2023年4月,Vedanta Biosciences完成AMR Action Fund和AXA Investment Managers领投的1.065亿美元E轮融资,Korea Investment Partners、Seventure Partners、Bill & Melinda Gates Foundation、Hambro Perks Ltd.、Pfizer等跟投。
Vedanta Biosciences美股投资
非上市公司,等待Vedanta Biosciences IPO上市。




评论